HvJ EU: Houder standaard essentieel octrooi maakt geen misbruik van machtspositie, wanneer...
HvJ EU 16 juli 2105, IEF 15127; C-170/13; ECLI:EU:C:2015:477 (Huawei tegen ZTE) - persbericht
 Octrooirecht. Onderneming houdster van een standaard-essentieel octrooi, die zich jegens een standaardisatieorganisatie de verbintenis is aangegaan aan derden licenties te verlenen onder eerlijke, redelijke en niet-discriminerende voorwaarden, genoemd ‚FRAND’(‚fair, reasonable and non-discriminatory’)-voorwaarden – Misbruik van machtspositie – Beroepen wegens inbreuk – Vordering tot staken – Vordering tot terugroeping van producten – Vordering tot verstrekking van boekhoudkundige gegevens uit het verleden (toegestaan) – Vordering tot schadevergoeding – Verplichtingen van de houder van het standaard-essentieel octrooi. Het hof verklaart voor recht:
Octrooirecht. Onderneming houdster van een standaard-essentieel octrooi, die zich jegens een standaardisatieorganisatie de verbintenis is aangegaan aan derden licenties te verlenen onder eerlijke, redelijke en niet-discriminerende voorwaarden, genoemd ‚FRAND’(‚fair, reasonable and non-discriminatory’)-voorwaarden – Misbruik van machtspositie – Beroepen wegens inbreuk – Vordering tot staken – Vordering tot terugroeping van producten – Vordering tot verstrekking van boekhoudkundige gegevens uit het verleden (toegestaan) – Vordering tot schadevergoeding – Verplichtingen van de houder van het standaard-essentieel octrooi. Het hof verklaart voor recht:
1) Artikel 102 VWEU moet aldus worden uitgelegd dat de houder van een octrooi dat essentieel is voor een door een standaardisatieorganisatie opgestelde standaard, die jegens deze standaardisatieorganisatie de onherroepelijke verbintenis is aangegaan om aan derden een licentie te verlenen onder eerlijke, redelijke en niet-discriminerende voorwaarden, genoemd „FRAND”(„fair, reasonable and non-discriminatory”)-voorwaarden, geen misbruik van zijn machtspositie in de zin van dat artikel maakt door een beroep wegens inbreuk in te stellen strekkende tot staking van de inbreuk op zijn octrooi of tot terugroeping van de producten voor de vervaardiging waarvan gebruik is gemaakt van dit octrooi, wanneer:
– hij vóór de instelling van dat beroep, enerzijds, de vermeende inbreukmaker in kennis heeft gesteld van de inbreuk die hem wordt verweten, met vermelding van dat octrooi en met precisering van de wijze waarop daarop inbreuk is gemaakt, en anderzijds, nadat de vermeende inbreukmaker te kennen heeft gegeven dat hij bereid is een licentieovereenkomst te sluiten onder FRAND-voorwaarden, deze inbreukmaker een concreet en schriftelijk aanbod van een licentie onder dergelijke voorwaarden heeft gedaan en daarbij met de name de royalty en de wijze van berekening daarvan nader heeft aangegeven, en
– die inbreukmaker het betrokken octrooi blijft gebruiken en niet met bekwame spoed overeenkomstig de handelsgebruiken en te goeder trouw gevolg geeft aan dit aanbod, hetgeen dient te worden uitgemaakt aan de hand van objectieve elementen en inhoudt dat er geen sprake is van vertragingstactiek.
2) Artikel 102 VWEU aldus moeten worden uitgelegd dat het, in omstandigheden als aan de orde in het hoofdgeding, een onderneming met een machtspositie die houdster is van een octrooi dat essentieel is voor een door een standaardisatieorganisatie opgestelde standaard, waarvoor zij jegens deze standaardisatieorganisatie de verbintenis is aangegaan licenties te verlenen onder FRAND-voorwaarden, niet verboden is tegen degene die inbreuk zou hebben gemaakt op haar octrooi, een beroep wegens inbreuk in te stellen strekkende tot het verstrekken van boekhoudkundige gegevens over de in het verleden verrichte handelingen van exploitatie van dit octrooi of tot schadevergoeding voor deze handelingen.
Gestelde vragen [IEF 12519]:
1) Maakt de houder van een [SEO] die aan een standaardisatieorganisatie heeft verklaard bereid te zijn aan derden een licentie te verlenen onder [FRAND-voorwaarden], misbruik van zijn machtspositie wanneer hij tegen een inbreukmaker een voordering tot staken instelt, hoewel die inbreukmaker zich bereid heeft verklaard te onderhandelen over een dergelijke licentie,
of
is er pas sprake van misbruik van machtspositie wanneer de inbreukmaker de octrooihouder een aanvaardbaar onvoorwaardelijk voorstel voor het sluiten van een licentieovereenkomst heeft gedaan dat de octrooihouder niet kan afwijzen zonder de inbreukmaker op onbillijke wijze te belemmeren of zonder het non-discriminatiebeginsel te schenden, en de inbreukmaker, vooruitlopend op de te verlenen licentie, voor reeds gemaakt gebruik de krachtens die overeenkomst op hem rustende verplichtingen nakomt?
2) Voor het geval dat misbruik van machtspositie reeds als gevolg van de bereidheid van de inbreukmaker tot onderhandelen dient te worden aangenomen:
Stelt artikel 102 VWEU bijzondere kwalitatieve en/of temporele eisen aan de bereidheid tot onderhandelen? Kan een dergelijke bereidheid al worden aangenomen wanneer de inbreukmaker louter in algemene bewoordingen (mondeling) heeft verklaard bereid te zijn te onderhandelen, of moet de inbreukmaker al aan het onderhandelen zijn en bijvoorbeeld al de concrete voorwaarden hebben vermeld waaronder hij bereid is een licentieovereenkomst te sluiten?
3) Indien er slechts sprake is van misbruik van machtspositie wanneer een aanvaardbaar en onvoorwaardelijk voorstel voor het sluiten van een licentieovereenkomst is overgelegd:
Stelt artikel 102 VWEU bijzondere kwalitatieve en/of temporele eisen aan dit voorstel? Moet het voorstel alle bepalingen bevatten die gewoonlijk in licentieovereenkomsten op het betrokken technische gebied worden opgenomen? In het bijzonder, kan het voorstel afhankelijk worden gesteld van de voorwaarde dat het betrokken octrooi daadwerkelijk wordt gebruikt en/of geldig blijkt te zijn?
4) Indien er slechts sprake is van misbruik van machtspositie wanneer de inbreukmaker de verplichtingen nakomt die voor hem voortvloeien uit de te verlenen licentie:
Stelt artikel 102 VWEU bijzondere eisen met betrekking tot de handelingen die de inbreukmaker verricht ter nakoming van die verplichtingen? Is de inbreukmaker gehouden, een overzicht van de reeds verrichte exploitatiehandelingen te verstrekken en/of royalty’s te betalen? Kan een verplichting tot betaling van royalty’s in voorkomend geval ook worden nagekomen door middel van het stellen van een zekerheid?
5) Gelden de voorwaarden waaronder misbruik van machtspositie door de houder van een [SEO] dient te worden aangenomen, ook voor het instellen van andere vorderingen wegens inbreuk (verstrekking van boekhoudkundige gegevens, terugroeping van de producten, schadevergoeding)?
Op andere blogs:
Dirkzwager
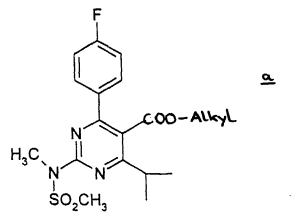 Octrooirecht. ABC. Afstandsleer. Shionogi is farmaceutische onderneming en houdster van ABC 300125 voor 'Rosuvastatinum, desgewenst in de vorm van een niet-toxisch farmaceutisch aanvaardbaar zout, in het bijzonder het calciumzout', voorheen houdster van EP471 'Pyrimidinederivaten als HMG-CoA-reductase-inhibitoren’. Resolution vordert met succes de partiële nietigheid van het octrooi en ABC vanwege toegevoegde materie; voor zover de bescherming ervan zich uitstrekt over andere producten dan in EP 471 genoemde niet-toxische farmaceutisch aanvaardbare zouten van rosuvastatine.
Octrooirecht. ABC. Afstandsleer. Shionogi is farmaceutische onderneming en houdster van ABC 300125 voor 'Rosuvastatinum, desgewenst in de vorm van een niet-toxisch farmaceutisch aanvaardbaar zout, in het bijzonder het calciumzout', voorheen houdster van EP471 'Pyrimidinederivaten als HMG-CoA-reductase-inhibitoren’. Resolution vordert met succes de partiële nietigheid van het octrooi en ABC vanwege toegevoegde materie; voor zover de bescherming ervan zich uitstrekt over andere producten dan in EP 471 genoemde niet-toxische farmaceutisch aanvaardbare zouten van rosuvastatine. Uitspraak ingezonden door namens Otto Swens en Ricardo Dijkstra,
Uitspraak ingezonden door namens Otto Swens en Ricardo Dijkstra,  Octrooirecht. Zie eerder AG [
Octrooirecht. Zie eerder AG [ Octrooirecht. Incident. Zaak verwijderd uit het versnelde regime voor de octrooiprocedure omdat de aanhouding van de behandeling van de inbreukvraag op
Octrooirecht. Incident. Zaak verwijderd uit het versnelde regime voor de octrooiprocedure omdat de aanhouding van de behandeling van de inbreukvraag op  Uit het
Uit het  Uit het persbericht: The European Patent Organisation has launched a structural reform of its Boards of Appeal. The main features of the proposed reform are described in the
Uit het persbericht: The European Patent Organisation has launched a structural reform of its Boards of Appeal. The main features of the proposed reform are described in the  Uitspraak ingezonden door Francis van Velsen,
Uitspraak ingezonden door Francis van Velsen,  Met samenvatting van Rutger Kleemans,
Met samenvatting van Rutger Kleemans,  Redactionele bijdrage van Jenny Cromsigt,
Redactionele bijdrage van Jenny Cromsigt, 


























































































